文章內容
顯微鏡變顯「奈」鏡了!

超解析螢光顯微鏡的發明,獲得了2014年諾貝爾化學獎的肯定。光學顯微鏡的進展,究竟是如何將影像解析度從「微米」尺度縮小到「奈米」尺度……
在十七世紀光學顯微鏡發明後,微米(10-6公尺)大小的細胞映在人類眼前,開啟了微生物學。1873年,恩斯特.阿貝(Ernst Abbe)證明了光學顯微鏡的解析度只能達到光波長的二分之一左右,稱為阿貝繞射極限(Abbe diffraction limit)。人類所能看到的光波長在400奈米(10-9公尺)到700奈米左右,因此200奈米或0.2微米一直是一般光學顯微鏡解析度無法突破的瓶頸。
如圖一所示,在光學顯微鏡發明後的幾百年間,微米左右的物體一直是人類所能觀察到的最小尺度。「微」這個字,被用來形容非常小的物體。顯微鏡的英文為microscope,而微米的英文為micrometer。直到二十世紀初電子顯微鏡(electron microscope)的問世,人類才開始看到奈米大小的物體。之後英文多了一個新名詞nanoscope,強調該儀器能看到nanometer(奈米)等級的物體,但是「顯奈鏡」這個名詞在中文並沒有被廣泛使用。現今,「顯微鏡」這個名詞不管是中文還是英文,已不代表只能看見微米尺度的儀器。顯微鏡的功用是將微小物體的影像放大,使肉眼能夠看見。不過生活用語中的顯微鏡,仍大多指光學顯微鏡。
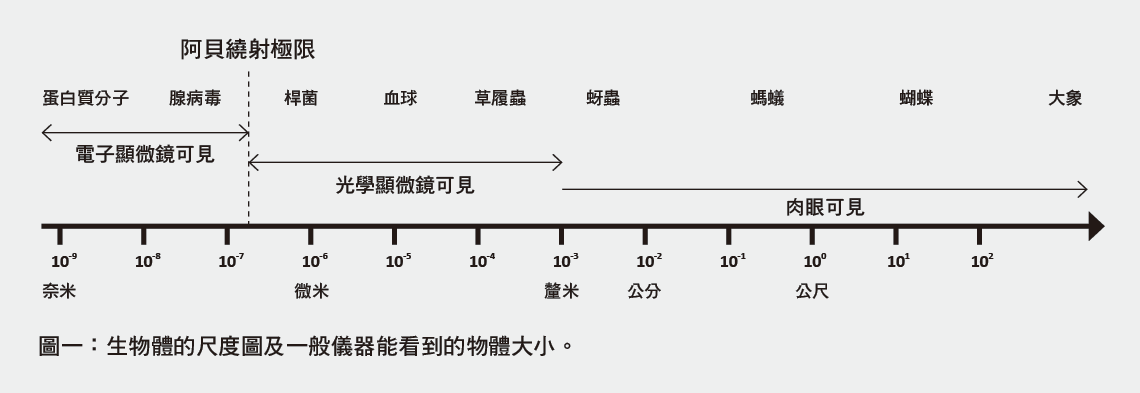
既然電子顯微鏡的解析度能看到奈米物體,為什麼一般光學顯微鏡仍是生命科學領域重要的研究工具呢?主要原因在於電子顯微鏡只能觀察經過冷凍切片處理的生物樣品。換言之,樣品是死的。原子力顯微鏡(atomic force microscope, AFM)也是擁有奈米解析度的儀器,目前已發展到可觀察水中的活細胞。然而原子力顯微鏡只能觀察到樣品表面的形貌,無法看到細胞內部的構造。雖然一般光學顯微鏡的解析度遠比電子顯微鏡與原子力顯微鏡解析度差,但是具有觀察活細胞內部構造隨時間變化的優勢。因此,光學顯微鏡至今仍是研究生命科學很普遍的利器。
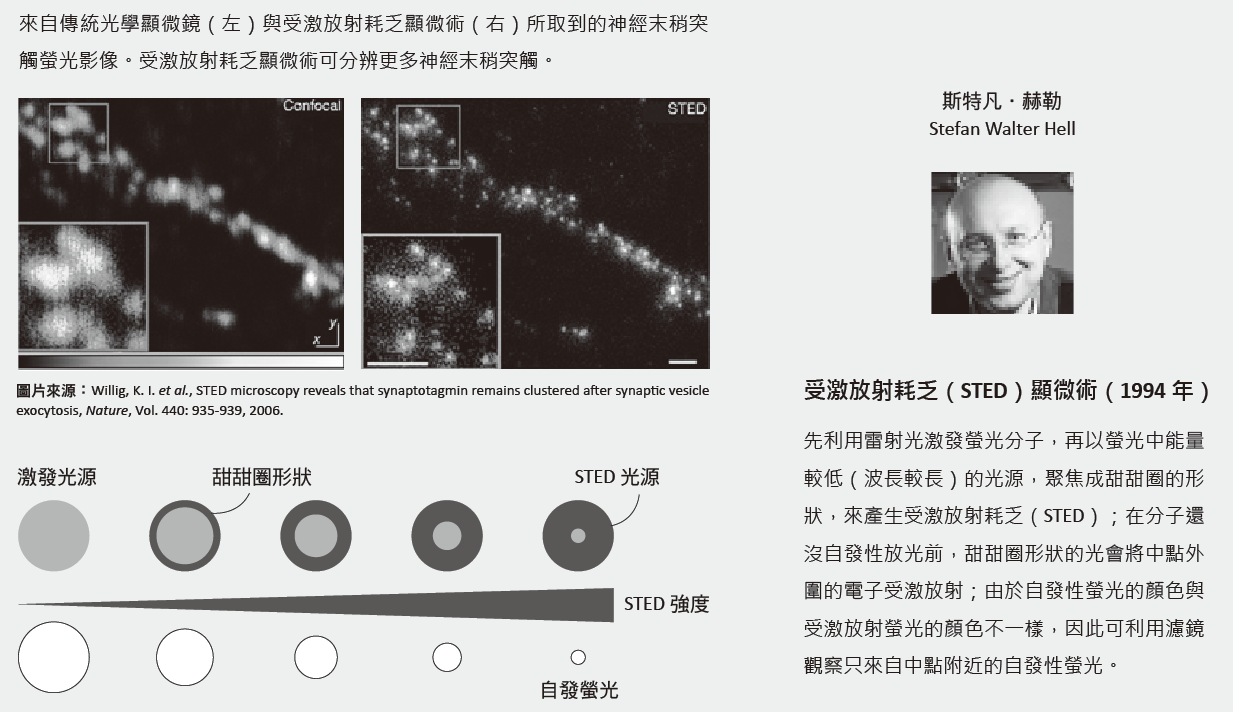
超解析螢光顯微鏡(super-resolution fluorescence microscope)的發明出現了新契機。所謂「超解析」的意思是突破阿貝繞射極限,讓解析度進入幾十奈米,使科學家可以觀察活細胞內奈米物體的變化,譬如研究分子如何在腦內神經細胞之間形成突觸。2014年,瑞典皇家科學院將諾貝爾化學獎頒給了美國霍華德休斯醫學研究所(Howard Hughes Medical Institute)的艾力克.貝吉格(Eric Betzig)、德國馬克斯.普朗克生物物理化學研究所(Max Planck Institute for Biophysical Chemistry)的斯特凡.赫勒(Stefan Walter Hell),以及美國史丹福大學(Stanford University)的威廉.莫厄納(William Esco Moerner)三人,表揚他們將光學顯微鏡帶到奈米世界的貢獻。
❐與阿貝繞射極限的直接對抗
阿貝繞射極限(Abbe diffraction limit)證明了一般光學顯微鏡的解析度,物理上只能達到光波長的二分之一左右。然而,科學家們仍然想盡各種辦法希望能夠突破阿貝繞射極限,直接看到超高解析度光學影像。近場光學掃瞄顯微鏡(near-field scanning optical microscope, NSOM)是其中一個直接的方法,其原理與原子力顯微鏡很類似,利用光纖當作針尖,以非常靠近待測物表面至幾個奈米的距離,掃描待測物的光訊號。雖然近場光學顯微鏡可利用微小的針尖達到20奈米解析度,但是針尖愈小,收光效率愈差,在生物影像應用上沒有得到好的成效。
另一方面,如果對於照明光源的物理特性瞭若指掌,也可藉由數學分析,得到超解析光學影像。譬如,構造化照明顯微術(structured illumination microscopy, SIM)藉由控制照明光的週期圖案與待測物的干涉形成雲紋圖形(moiré pattern),並將影像經過計算後,其解析度可突破繞射極限。雲紋圖形的原理如圖二:兩個很密的週期圖案旋轉一個小角度時,原本小的週期結構會變成較大的週期圖案,使得一般光學系統容易解析。經由數學方法,構造化照明顯微術可以將一般光學影像的解析度提高到兩倍以上。國內中研院應用科學研究中心李超煌博士所發明的超解析光學顯微鏡,也是利用調控光源與待測物的交互作用,藉由影像後處理得到小於200奈米以下的解析度。
❐在了解單一螢光分子後
螢光分子在受到高能量(短波長)的光激發以後,會放出較低能量(長波長)的光,稱為螢光(fluorescence)。螢光顯微鏡已經是生命科學中很常見的研究工具,藉由抗體來標定細胞內的特定胞器或分子,再將螢光分子鍵結到抗體後,即可由螢光的放光位置,追蹤染色的特定胞器在細胞內的形態。綠螢光蛋白質(green fluorescent protein, GFP)的發現,使得細胞不需經由額外螢光染色便可直接觀察,成為活細胞動態變化觀察的強力工具。因此,諾貝爾獎在2008年表彰綠螢光蛋白質的合成技術,讓螢光顯微鏡能用來觀察活細胞的形態變化。

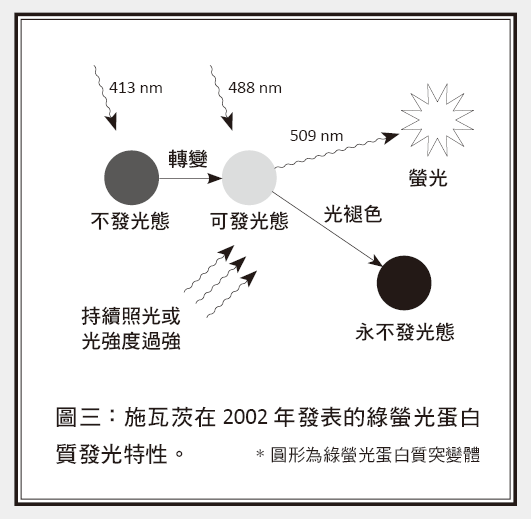
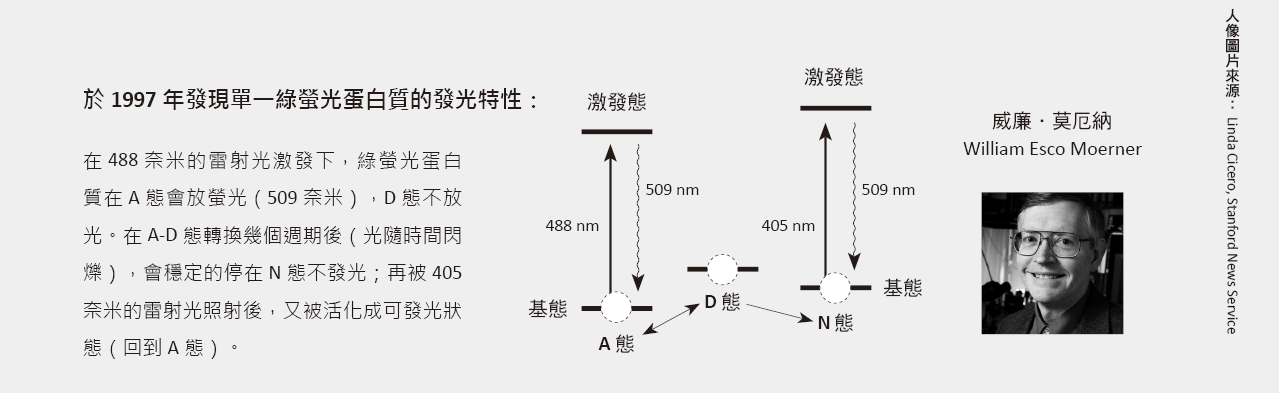
1989年,莫厄納首度量測到單一分子對光的吸收,開啟了單一分子的研究領域,吸引許多科學家投入。1997年,莫厄納在單一綠螢光蛋白質分子的突變體有重要的發現,引發了許多利用光活化(photoactivation)來控制綠螢光蛋白質發光的研究,譬如2002年,美國國家衛生院的利平科特.施瓦茨(Jennifer Lippincott-Schwartz)在Science期刊發表了一種綠螢光蛋白質突變體:圖三中,原本不會發光的綠螢光蛋白質突變體,在413奈米雷射光照射後會變成活化態,被488奈米光激發可放出螢光(509奈米);而在持續以488奈米光激發下,分子最後會因為光褪色效應(photobleaching),無法再被活化而放出螢光。
❐開關螢光分子閃過阿貝繞射極限
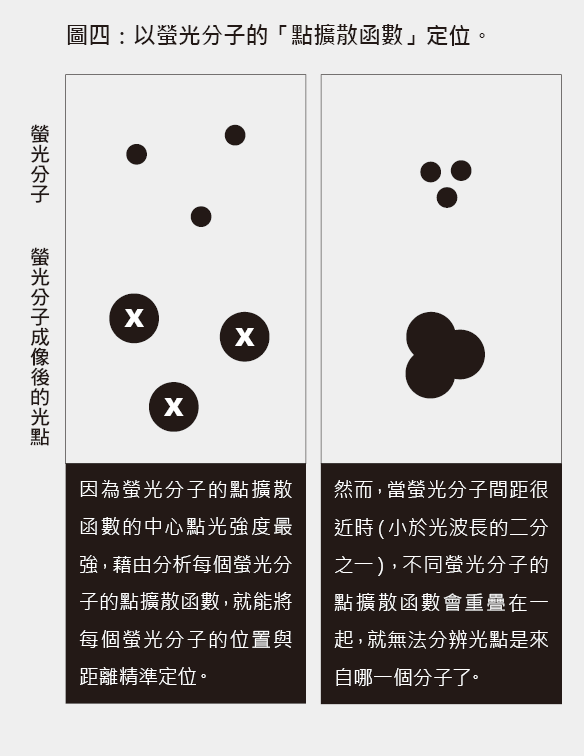
一個很小的點光源(譬如奈米大小的螢光分子)經過一般光學成像系統後,這個小光點會大到跟光波長的尺度差不多,而這個成像光點的光強度變化,可以用點擴散函數(point spread function, PSF)來描述(圖四)。阿貝繞射極限定義的解析度,即分辨不同小物體距離的能力,而當螢光分子間距很近時(小於光波長的二分之一),不同螢光分子的點擴散函數會重疊在一起,而無法分辨光點是來自哪一個分子。
1995年,貝吉格提出了利用螢光分子提高解析度的想法:如果將不同顏色的螢光分子均勻染色在樣品中,讓每個顏色的螢光分子間距都大於阿貝繞射極限,則可利用點擴散函數中心點光強度最強的性質,將分子精準定位。只要將每個顏色的定位影像組起來,即使不同顏色的螢光分子距離只有幾奈米,還是能解析出來。不過,要把這個想法實現很困難。譬如要如何將不同顏色的螢光分子均勻染色?
經過了好幾年,貝吉格看到了2002年施瓦茨在Science期刊發表綠螢光蛋白質的獨特光學性質結果,讓他有機會實現在1995年提出的想法。他發現實驗上並不需要區分螢光顏色,還是可以利用不同時間活化綠螢光蛋白質的方式,來組合超高解析影像。他先以很弱的雷射光(413奈米),隨機讓少數綠螢光蛋白質活化(參考圖三),因此活化的綠螢光蛋白質之間的距離都比阿貝繞射極限還要大;再用另一雷射光(488奈米)激發螢光,然後根據每個螢光的點擴散函數,把各綠螢光蛋白質精確定位,成為第一個子圖;當第一組活化的綠螢光蛋白質因為光褪色無法再被活化後,再不斷重覆上述步驟,記錄下許多子圖,最後就可以組成一張超解析度影像。貝吉格把這個技術稱為光活化定位顯微術(photoactivated localization microscopy, PALM),並與施瓦茨合作實現了這個想法。同年,美國哈佛大學的莊曉薇也參考了貝吉格1995年的構想,實驗證實利用其他生物常用的螢光分子隨機發光特性,也可達到超解析度,並命名為隨機光學重建顯微術(stochastic optical reconstruction microscopy, STORM)。

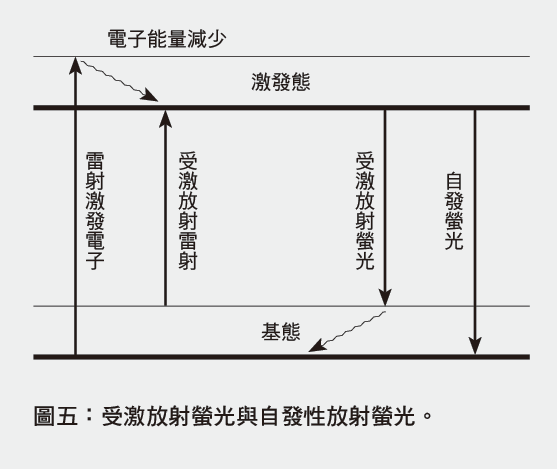
過去二十年赫勒也一直想著如何突破阿貝繞射極限,而他是從螢光分子的另一個性質著手。螢光分子有基態(ground state)跟激發態(excited state),基態與激發態中還有不同能量的振動態(vibrational state)。當激發光源將電子從基態躍遷到激發態後,電子能量會在0.1奈秒(nanosecond,10-9秒)內從高振動態遞減,並在最低振動態停留幾奈秒。最後當電子躍遷到基態中任何一個振動態而放出的光,即稱為自發性放射(spontaneous emission),一般螢光顯微鏡所觀察的光即是自發性放射的螢光;然而,若電子在激發態時,遇到另一道光剛好對應在電子可躍遷的能量時,電子會受到刺激而馬上躍遷到基態並放出光,即受激放射(stimulated emission)(圖五)。
當赫勒了解螢光分子「受激放射」的性質後,他想到了一個利用螢光的開關來提升影像解析度的方法,於1994年發表了受激放射耗乏(stimulated emission depletion, STED)顯微術。2000年以後,赫勒開始實驗證明這個想法是可行的。他結合激發雷射與受激放射耗乏雷射,聚焦在螢光分子染色的生物樣品,藉由奈米精確度的掃描,可得到超解析螢光影像。
❐螢光的指引
超解析螢光顯微鏡提供了發展光學顯微鏡一個不同的思維。在沒有利用螢光分子的特殊性質前,超解析光學顯微鏡是利用對「光」性質的了解去設計的,與所要觀察的樣品無關。超解析螢光顯微鏡的原理所帶來的啟發,是可以針對觀察物的性質,譬如螢光的開關控制行為去進一步提升光學影像解析度;國內部分研究就是受到這個概念所啟發,譬如中研院原子與分子科學研究所張煥正博士利用螢光奈米鑽石(fluorescent nanodiamond)發展受激放射耗乏顯微術,臺大物理學系朱士維教授利用金奈米粒子的飽和作用,達成超解析光學影像;筆者就讀臺大光電工程學研究所時與指導教授孫啟光發表了利用脈衝雷射在氮化銦鎵奈米薄膜產生音波的非線性效應,突破光學繞射極限取得奈米解析度超音波影像。
結合人類原本就對光傳播性質的了解,利用調控光源與待測物的交互作用,及螢光分子的特殊性質,讓超解析螢光顯微鏡發展更快。譬如本文之前提到的構造化照明顯微鏡,可藉由螢光分子的飽和效應進一步提升解析度,稱為飽和構造化照明顯微術(saturated structured illumination microscopy, SSIM)。超解析螢光顯微鏡也搭配光源的分析,進一步發展出三維奈米解析度的光活化定位顯微術(3D-PALM)、三維隨機光學重建顯微術(3D-STORM)、三維受激放射耗乏顯微術(3D-STED)等。
❐未來方向
雖然超解析螢光顯微鏡已經證明可以直接觀察活細胞內奈米等級的蛋白質與胞器,然而科學家是不會永遠滿足於目前的解析度。超解析螢光顯微鏡的解析度有賴於好的螢光分子特性,譬如開關的控制或隨機性,及被雷射光打壞的功率上限;發展出好的螢光分子,能更方便地染在活細胞裡,是一條很清楚的路。
顯微鏡除了在解析度的追求,科學家也希望提升影像速度,方便觀察細胞內快速的動態行為,目前這些技術最快也需要1秒左右取得一張高解析二維影像。為了解決影像速度的問題,近幾年來,光片照明顯微術(light-sheet microscopy)開始蓬勃發展,今年從貝吉格實驗室回國的陳壁彰博士也開始在中研院應用科學中心發展光片照明顯微術。我們期待更好的光學顯微鏡讓科學家未來在生命科學領域有更多突破發現,幫助人類對抗疾病,改善人類的生活。
筆者感謝中研院應用科學研究中心陳壁彰博士協助校稿,中研院物理所生物影像核心設施吳紫綾小姐協助潤稿及繪圖。
林宮玄:任職中央研究院物理研究所
【延伸閱讀】其他精彩內容請線上訂閱「科學月刊」。<我要訂閱>
Nobelprize.org, The Nobel Prize in Chemistry 2014, http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2014/, 2014.
