文章內容
紅血球—運輸氧氣的精巧錯合物列車

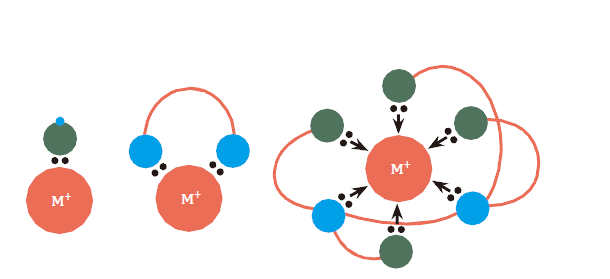
圖一:由左至右,單牙基,雙牙基與多牙基配位子
錯合物具有千變萬化的結構,功能更是各顯神通。紅血球—就是高效率輸
送氧氣到肌肉,含有四節精巧錯合物車廂的一班列車。然而,到底錯合物是什麼呢?
❒配位子能力各不同
錯合物即配位化合物,主要是由金屬離子為中心,和配位子鍵結而形成的。配位子大多含有氮、氧、磷、硫、鹵素等原子,提供孤對電子與金屬離子形成配位鍵,若配位子有很多原子可以提供孤對電子,其形狀就可以分成單牙基、雙牙基和多牙基(圖一)。單牙基配位子上只有一個部位可以與金屬結合;雙牙基有兩個鍵結的位置,能像是筷子一樣的夾住金屬;而多牙基更像是多隻強力章魚爪牢牢握住。單牙基配位子與金屬間的接合直接,比較容易被拔除或是進行置換,而如EDTA這個六牙基,當它與一個金屬離子結合,真可以說是四面八方的把金屬給抱在懷中,穩定度比起單牙基、雙牙基都高很多。
紅血球中有含氮的有機雜環分子─紫質,則是一種特殊的平面四牙基,以
四個氮圍繞成中間的孔洞與金屬結合,外側的許多碳原子組成共軛系統,形成一個又圓又平的大圓盤,賦予紫質許多特殊的性質,中間的孔洞接上鐵離子之後,就是所謂的血紅素(圖二)。
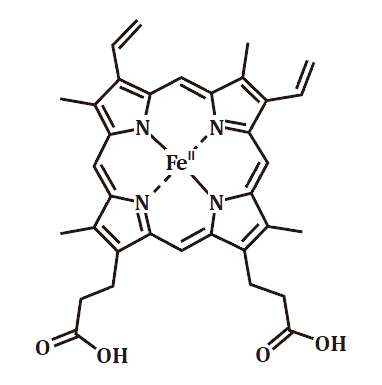
圖二:血紅素。
❒變化多端的金屬離子
錯合物的中心是金屬離子,金屬離子有數十種,從鹼金屬、鹼土金屬、過渡金屬、鑭金屬、錒系金屬等共有七十多種,它們的氧化態又可以不同,例如常見的錳就有0、2、3、4、6 及7 等,可以結合配位數的選擇又有1、2、3⋯⋯到12之多,結構有線形、三角形、四面體、平面四方形、三角雙錐形、四方錐形、八面體、三稜形、立方體等變化,可以想見其千變萬化各顯神通。配位化合物中心金屬離子和鍵結其上的配位子,各自提供了優勢立體選擇及授受電子的能力,直接影響金屬與配位子之間鍵結的強弱及形狀,我們不難想像這個配位子與金屬離子的連結有多麼奇幻精彩。
瑞士化學家維爾納(Alfred Werner,1866~1919,1913 年諾貝爾獎得主)確立各種錯合物構造,建立理論之後,配位化合物才廣泛被人們深入研究。因為配位化合物易於結合拆解、具多變結構與可調控中心金屬氧化態等,使得它具有特異的光、電、熱、磁和化學功能,被廣泛的應用在醫藥、生化、光電、材料、催化等領域。
❒氧氣輸送需仰賴錯合物
氧氣,是人類最熟悉也最重要的氣體,兩個氧原子透過雙鍵互相連接並分享彼此的電子。這樣一個小小的雙原子分子,具有強氧化力,使得氧氣非常容易與金屬反應。氧氣在人體內所參與的氧化反應很多,提供了熱能與動能。每個氧上留了兩組的孤電子對,也可當作配位化合物中的配位子,但是要把氧氣帶到身體的各處組織,可真不簡單,還得靠紅血球中特異功能的錯合物才能進行。
當氧氣被人類吸入肺部以後,就要準備與紅血球中的血紅素結合。血紅素是一個以鐵離子為中心,以紫質為配位子的金屬配位化合物,紫質邊緣的許多官能基負責將錯合物固定在血紅蛋白複雜的結構上,而血紅素與鐵離子在兩價與三價的變化、空間上相對位置的表現,可以說是配位化合物在結構與氧化態變化上最經典的例子之一。
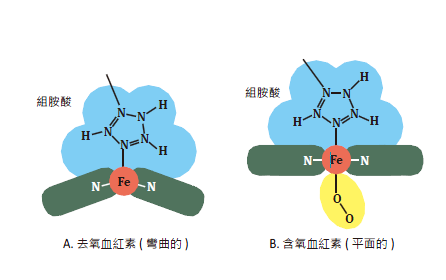
圖三:彎曲的去氧血紅素與平面的含氧血紅素。
❒去氧血紅蛋白
當沒有氧氣的時候,去氧狀態血紅素的中心的鐵離子是正二價,這個鐵(II)離子除了與紫質平面上的那四個氮鍵結之外,還與血紅蛋白上延伸出來的一個胺基酸鍵結,這個胺基酸叫做組胺酸(histidine)。組胺酸上的咪唑官能基有氮原子可以與金屬形成配位鍵,於是形成了一個鐵的五配位錯合物。如果我們看一下這個還沒接上氧氣的血紅素形狀,我們會發現這個甜甜圈中心的鐵離子有一面被血紅蛋白上延伸出來的組胺酸給拉住了,同時,這個距離使得組胺酸上的電子雲與紫質共軛系統上的電子雲靠近到會互相排斥,使得紫質從本來的平面形狀變凹了!於是鐵離子稍微偏離了原本紫質的中心,在軸向的位置上往組胺酸這一側偏離,造成血紅素這個扁平的碟子中間凹陷了下去,變成有點像一個碗(圖三A),等著承受氧分子。
然而,鐵離子最喜歡的配位環境其實還是六配位的,對於去氧血紅素的鐵離子來說,僅有的五配位結構還缺了一腳。因此當氧氣被吸入肺部,血液中的氧氣濃度高出很多,開始有氧氣分子順著血紅蛋白的疏水環境,進入血紫質的鐵上。鐵遇氧則鏽成鐵(III)離子,所以雖然鐵離子很想要和這個氧氣分子作用,但是蛋白質的結構會拉住氧氣,限制這個反應的進行。血紅素上紫質的這個大盤子,也限制了氧氣靠近的方向,因此氧氣不能從其他方向靠近鐵離子,只有一個氧氣分子能從通道進入軸向空位與鐵相互鍵結,補足鐵離子的第六個配位數。而且,氧氣若即若離的,並沒有將兩價的鐵離子氧化。
❒含氧血紅蛋白
當氧氣順利與鐵離子鍵結,滿足了鐵的六配位結構,形成含氧血紅素後,血紅素的結構發生了微妙的變化。氧氣為鐵所帶來的是其一端的孤電子對,當鐵氧鍵形成後,雖然鐵沒有被氧化成+3 價,但是電子結構仍舊因為配位鍵的形成而發生改變,使鐵的離子半徑略為縮小,於是鐵離子就從本來在紫質外的位置,嵌入到四個氮的中間,安穩的坐落到平面中心位置上。另一方面,在紫質另一側的組胺酸,由於鐵離子上電子密度重新分配的影響,改變了鍵結強度,使組胺酸與紫質的相對位置跟著改變,結果對紫質共軛系統的排斥力降低,就使得紫質從原本凹陷的碗狀恢復為一個平面碟子般的結構(圖三B)。
這些鐵離子價數,配位數,離子半徑與配位子構型上的微小轉變,對整個血紅蛋白卻有非常重大的影響,可謂是牽一髮而動全身。血紅蛋白是由兩種稱為α 與β 次單元(subunit),共四條鏈狀的胜肽鏈組合而成,這四個次單元兩兩一組形成二聚體α1β1 與α2β2,每個次單元上都帶著一個血紅素分子(所以一個血紅蛋白有四個血紅素)。在正常的情況下,這四個次單元盤繞折疊,把血紅素分子包覆在重重的胜肽鏈中,所以我們可以想見,氧氣要與血紅素的鐵離子結合,勢必要通過這些複雜的蛋白質結構。血紅素的結構變化,透過與鐵離子鍵結的組胺酸牽動整個次單元二聚體,讓他們旋轉了一個角度(圖四),不止帶動整個次單元上胺基酸位置的改變,更使得在血紅蛋白上其他位置的血紅素,被轉變成更有利於與其他氧氣鍵結。於是,只要有一個氧氣鍵結,另外三個血紅素就更容易獲得氧氣,這個現象,稱為協同效應。
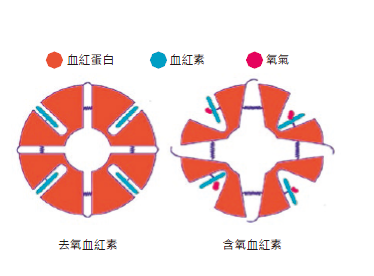
圖四:氧氣對血紅素與血紅蛋白結構的影響。
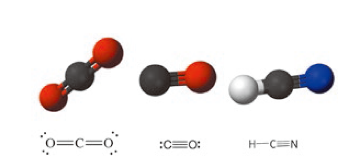
圖五:由左至右,二氧化碳、一氧化碳、氰化物分子。
既然血紅蛋白輸送氧氣是由鐵– 紫質的配位化合物做為核心,除了氧氣之外,其他類似大小、形狀,具有未鍵結電子的分子,當然也會有機會進入血紅蛋白與鐵結合,直線的雙原子分子如二氧化碳、一氧化碳、氰化物(圖五),都有可能夠通過蛋白質的通道,與鐵形成配位鍵結。一氧化碳與血紅素的結合能力比氧氣大250 倍,Fe-CO 形成的配位鍵已經接近雙鍵,遠強於Fe-O2 的鍵結,這樣子的鍵結一經形成,就霸占了鐵再也不放開,等同於癱瘓了血紅素的功能,這就是一氧化碳中毒的主因。
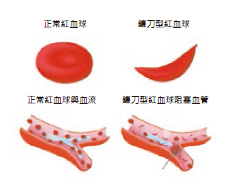
圖六:正常的紅血球與鐮刀型紅血球。
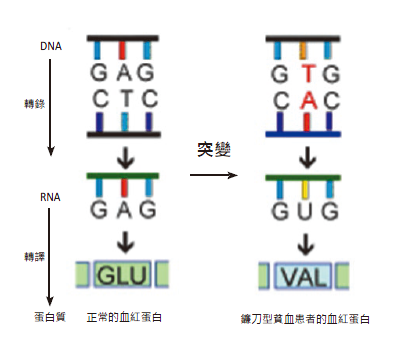
圖七:單一DNA 核苷酸突變的血紅蛋白。
❒鐮刀型紅血球症
紅血球的外型像個小柿餅、甜甜圈,中心有個小酒窩,但有些人會因遺傳而病變,成為細長的新月狀(圖六),稱為鐮刀型紅血球症(Sickle-cell disease, SCD)。它的攜帶氧氣能力較低、易破裂,易使微血管阻塞,造成組織局部缺血缺氧,患者的平均壽命低於40 歲。
追根究柢,就因為DNA 序列的1692 個鹼基的其中1 個發生突變,其第二十個核苷酸由腺嘌呤(A, Adenine)變成胸嘧啶(T, Thymine),也就是核苷酸序列由-GAG- 變成-GTG-,製成的β 蛋白質鏈上的第六個胺基酸,由麩胺酸(Glu, glutamic acid)改為纈胺酸(Val, valine)(圖七)。這一個由-COOH 換成-CH3 小小改變,使其由親水性變成疏水性,破壞了平衡,使結構由外而內翻,導致紅血球外型被壓扁了,功能大損。從演化的角度來看,鐮刀型貧血患者的壽命普遍較短,罹患此疾病的人數會因淘汰而降低,但這種疾病在瘧疾很普遍的撒哈拉以南地區卻很常見,原因何在呢?這是適者生存之道,因鐮刀型貧血患者對瘧疾有抗病性,感染率相對低非常多,因此得以躲過瘧疾的肆虐而存活。帶有鐮刀型貧血基因的人,反而成為優勢族群了。
每個人身上都流著血液,血紅蛋白上精巧的鐵錯合物構造,完美的輸送氧氣。但在數萬個原子的配位子中,只要幾個原子的改變,就能破壞其攜氧功能。其他眾多的金屬錯合物,在配位數、氧化態、結構的各種型態上,總是能提供給我們多采多姿的特性、功能與應用,這些千變萬化的錯合物真有意思!
作者/高憲章(任職於淡江大學化學系,負責「化學遊樂趣」計畫,隨一台行動化學車全臺跑透透,說故事作實驗分享化學給學生們)
...【延伸閱讀】其他詳細內容請參考「科學月刊第554期」。<我要訂閱>
